Compost inorgànic
| Substància química | classe estructural d'entitats químiques |
|---|

Un compost inorgànic és un compost químic format per elements que, entre ells, no es troba el carboni.
Tradicionalment un compost inorgànic es considera d'origen mineral no biològic. De forma complementària molts dels compostos orgànics es veuen tradicionalment com d'origen biològic. A partir del segle XX la classificació precisa dels compostos inorgànics oposats als orgànics ha passat a ser menys important pels científics, principalment a causa que la majoria dels compostos coneguts són d'origen sintètic i no pas d'origen natural. A més la majoria dels compostos de la moderna química inorgànica contenen enllaços orgànics. Els camps de la química organometàl·lica i la química bioinorgànica explícitament se centren en l'àrea entre els camps de la química orgànica, biològica i inorgànica.
Descripció dels principals grups de composts inorgànics
Hidrurs

Els hidrurs són combinació de l'hidrogen amb un altre element, gairebé sempre metàl·lic.
- Els hidrurs iònics formen xarxes cristal·lines amb anions hidrur, H–, i cations dels metalls. Els hidrurs alcalins tenen una estructura cristal·lina de cares centrades, mentre que els alcalinoterris tenen una estructura cúbica de cares centrades. Són sòlids a temperatura ambient i amb les propietats característiques dels composts iònics.
- Els hidrurs moleculars són substàncies d'enllaç covalent del tipus B₂H₆, PH₃, AsH₃, obtingudes fent reaccionar l'hidrogen atòmic sobre el no metall. Alguns d'ells en dissolució aquosa s'anomenen hidràcids. A les molècules d'aquests l'hidrogen es troba enllaçat mitjançant un enllaç covalent a un àtom d'un element químic molt electronegatiu (halògens, sofre, seleni i tel·luri) per la qual cosa l'enllaç està molt polaritzat i es romp fàcilment en dissolució aquosa, donant lloc a la dissociació de l'àcid. Els hidràcids més importants són: àcid fluorhídric, HF(aq) - àcid clorhídric, HCl(aq) - àcid bromhídric, HBr(aq) - àcid iodhídric, HI(aq) - àcid sulfhídric, H₂S(aq). El més important és l'àcid clorhídric. S'empra en la indústria tèxtil, en la dels colorants, per a la neteja dels metalls en la indústria del galvanitzat i de l'estanyat, per a la manufactura de filferros, en el procés de gravat, en la fabricació de dextrosa, gelatina i sabons, en la purificació d'arenes i argiles per a la fabricació de porcellanes i en l'elaboració de clor, clorurs i derivats.
- Els hidrurs radicals són agrupaments diatòmics incomplets, identificats per l'anàlisi espectral, en l'atmosfera estel·lar; no han pogut ésser aïllats a causa de llur labilitat química i de llur curtedat de vida. Hom els considera com a radicals lliures.
- Els hidrurs d'inserció són composts obtinguts fent absorbir l'hidrogen per certs elements de transició, com el titani (TiH₂). Hom suposa que l'hidrogen s'introdueix en les fissures intersticials de la malla metàl·lica i en modifica les propietats.
Els hidrurs són emprats com a agents reductors, com a carburants molt energètics i com a intermediaris de síntesi, molts dels quals, però, tenen un interès exclusivament teòric.
Òxids

Els òxids inorgànics són combinació de l'oxigen amb qualsevol element, excepte el fluor. Els òxids inorgànics poden ésser denominats anteposant al nom de l'element el mot òxid, amb els prefixos numèrics escaients, o bé mitjançant el sistema de Stock.
Els òxids són generalment obtinguts per reacció directa de l'oxigen amb l'element a alta temperatura. També poden ésser obtinguts per descomposició tèrmica d'altres substàncies més complexes i per reacció amb l'oxigen de composts tals com hidrurs metàl·lics, sulfurs i halurs.
- Amb els no metalls formen composts moleculars, volàtils, amb enllaç covalent. Exemples són el monòxid de carboni, CO, el diòxid de carboni, CO₂, el diòxid de sofre, SO₂, el monòxid de nitrogen, NO, el triòxid de dinitrogen, N₂O₃, el diclorur de pentaoxigen, O₅Cl₂, etc.
- Amb els metalls l'oxigen forma sòlids cristal·lins, amb enllaç, generalment iònic, degut a la baixa polarització de l'anió òxid, O2–. Exemples són l'òxid de sodi, Na₂O, l'òxid de ferro(III), Fe₂O₃, l'òxid de calci, CaO, l'òxid de zinc, ZnO, etc. Tanmateix, els òxids de metalls d'alta valència són volàtils, amb enllaç amb marcat caràcter covalent.
Els òxids tenen un gran nombre d'aplicacions en la indústria (semiconductor, ciment, vidre, pintura, refractari).
Oxoàcids


Els oxoàcids són composts inorgànics on un àtom central electronegatiu es troba enllaçat mitjançant enllaç covalent a diversos oxígens que amb enllaços dobles i simples completant les valències de l'àtom central. Els oxígens que es troben enllaçats mitjançant un enllaç simple a l'àtom central s'enllacen també a un àtom d'hidrogen. Aquest enllaç està molt polaritzat la qual cosa fa que sigui bo de dissociar.
Oxoàcids més importants: Àcid arsènic, H₃AsO₄ - Àcid arsenós, H₂AsO₃ - Àcid bòric, H₃BO₃ - Àcid bròmic, HBrO₃ - Àcid carbònic, H₂CO₃ - Àcid clòric, HClO₃ - Àcid clorós, HClO₂ - Àcid cròmic, H₂CrO₄ - Àcid difosfòric, H₂P₂O₇ -Àcid fosfòric, H₃PO₄ - Àcid fosforós, H₃PO₃ - Àcid hipobromós, HOBr(aq) - Àcid hipoclorós, HOCl(aq) - Àcid hipofosforós, H₃PO₂ - Àcid iòdic, HIO₃ - Àcid nítric, HNO₃ - Àcid nitrós, HNO₂ - Àcid perclòric, HClO₄ - Àcid perdisulfúric, H₂S₂O₈ - Àcid periòdic, HIO₄ - Àcid permonosulfúric, H₂SO₅ - Àcid selènic, H₂SeO₄ - Àcid selenós, H₂SeO₃ - Àcid silícic, H₄SiO₄ - Àcid sulfàmic, NH₂SO₃H - Àcid sulfúric, H₂SO₄ - Àcid sulfurós, H₂SO₃ - Àcid tel·lúric, H₂TeO₄ - Àcid tel·lurós, H₂TeO₃
- Aplicacions dels àcids inorgànics.
- Àcid sulfúric, H₂SO₄. L'àcid sulfúric és l'àcid que s'empra en major quantitat, s'empra en la indústria química per a la preparació d'altres àcids, de sulfats i de carbonats. En la producció de pintures, sulfonació de greixos, en la indústria tèxtil, en la refineria del petroli, en la producció de ferro i acer, en els acumuladors de plom i en la fabricació d'explosius.
- Àcid nítric, HNO₃. L'àcid nítric s'empra en la fabricació d'explosius, colorants, seda artificial, plàstics, fertilitzants i en la fabricació d'àcid sulfúric.
Hidròxids


Els hidròxids estan constituïts per anions hidroxil, OH–, i cations metàl·lics. En augmentar la capacitat de polarització del catió s'accentua el caràcter parcialment covalent de l'enllaç metall-oxigen, i l'estabilitat de l'hidròxid disminueix. Els hidròxids dels elements més electropositius (alcalins, alcalinoterris…) poden fondre's sense descompondre's (els dels alcalins poden, fins i tot, vaporitzar-se). En canvi, no es coneixen hidròxids en molt alt estat d'oxidació.
Els alcalins són els únics solubles en aigua. Els més reactius són els alcalins i els alcalinoterris. La propietat més destacada és el caràcter bàsic, tant en dissolució aquosa com en estat fus.
Sals


Les sals són composts iònics formats per combinacions d'anions amb cations metàl·lics. Tenen les propietats característiques dels composts iònics: són sòlids cristal·lins de punt de fusió elevat, presenten conducció de l'electricitat en l'estat líquid i conductivitat electrolítica en llurs solucions aquoses. Això no obstant, hi ha tota una gradació en el caràcter covalent o iònic de l'enllaç, el qual depèn fonamentalment de la diferència d'electronegativitat i de grandària dels ions que constitueixen la sal. Dos exemples extrems són el fluorur de cesi, CsF, que és totalment iònic, i el tetraclorur de titani, TiCl₄, que presenta un caràcter covalent molt accentuat. Quant a la solubilitat, les sals de caràcter iònic són generalment solubles en dissolvents de constant dielèctrica elevada, com és ara l'aigua, a desgrat de les que presenten una energia reticular molt gran, mentre que les de tipus més covalent se solubilitzen en dissolvents apolars (tetraclorur de carboni, etc.). D'altra banda, moltes sals iòniques formen hidrats, la tendència a la formació dels quals és donada pel guany energètic que suposa la solvatació, enfront de l'energia necessària per a trencar el reticle cristal·lí de la forma anhidra.
Segons llur constitució, les sals poden classificar-se en:
- Sals simples: són les sals formades pel catió d'una base i l'anió d'un àcid amb l'estequiometria adequada, com el clorur de sodi, NaCl, o el nitrat de potassi (KNO₃). N'hi ha de dos tipus:
- Sals binàries. Són sals simples constituïdes per anions d'un sol element químic. Exemples: fluorur de sodi, NaF, clorur de magnesi, MgCl₂, bromur de potassi, KBr, iodur de plom(II), PbI₂.
- Sals ternàries o oxisals. Són sals simples en les quals l'anió prové d'un oxoàcid. Exemples: nitrat d'argent, AgNO₃, dicromat de potassi, K₂Cr₂O₇, sulfat de ferro(III), Fe₂(SO₄)₃.
- Sals àcides: Són sals que contenen àtoms d'hidrogen àcids, com l'hidrogencarbonat de sodi, NaHCO₃.
- Sals dobles: Són sals que s'originen, en general, per cristal·lització de solucions que contenen mescles d'ions, com ara els alums, i les oxisals i hidroxisals, conegudes genèricament com a sals bàsiques, en les quals intervenen oxocations o hidroxications, com l'oxiclorur de bismut, BiClO, i l'hidroxiclorur de magnesi, MgCl(OH).
Quant a la nomenclatura, les sals són anomenades esmentant primer l'anió i després el catió, amb els prefixos numèrics corresponents. La presència d'hidrogen àcid és indicada mitjançant el prefix hidrogen- anteposat al nom de l'anió, mentre que en la nomenclatura de les oxisals i hidroxisals són emprats els prefixos oxi- i hidroxi- anteposats al nom de l'anió.
Complexos


Un complex o compost de coordinació és un compost químic que conté un àtom o un ió central, generalment d'un metall de transició, acceptador d'electrons, envoltat d'un grup d'ions o de molècules neutres (els lligands), donadors d'electrons.
El lligand pot unir-se a l'àtom central per un sol dels seus àtoms o per més d'un, en el primer cas s'anomena monodentat i en els altres polidentat (bidentat, tridentat, etc.). En els polidentats es formen estructures cícliques que reben el nom de quelats. Segons el nombre d'ions centrals, el complex és mononuclear, dinuclear, etc., o polinuclear. En alguns casos, els lligands contenen sistemes d'electrons π, més o menys deslocalitzats, que es poden unir amb metalls formant complexos π (com els de tipus sandvitx, com el ferrocè). També hi ha complexos dits de transferència de càrrega, que són d'enllaç dèbil, correntment moleculars, caracteritzats per passar, per absorció de llum visible, a un estat excitat amb una transferència de càrrega, que dona lloc a un augment de la participació de la forma amb covalència dativa en l'híbrid de ressonància.
Els complexos tenen formes geomètriques definides segons el nombre i el tipus dels orbitals atòmics de l'ió metàl·lic que participen en l'enllaç. Les més corrents són la quadrada (hibridació dsp²) i la tetraèdrica (hibridació sp³), per als metalls d'índex de coordinació 4, i l'octaèdrica (hibridació d²sp³) per als d'índex 6. Aquestes estructures permeten, en molts casos, l'existència d'isòmers geomètrics i d'isòmers òptics.
Les propietats químiques dels complexos no són les de constituents separats, sinó unes altres de pròpies de la nova unitat. Si els complexos són estables i inerts, tals propietats desapareixen del tot. La formació de complexos modifica les propietats acido-bàsiques dels constituents, en general exaltant la força àcida dels lligands; també modifica els potencials normals de reducció, de manera que molts estats d'oxidació anormals dels metalls són estabilitzats.
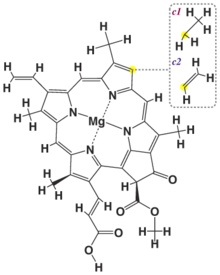
Els compostos de coordinació naturals són vitals per als organismes vius i juguen una varietat de rols importants en els sistemes biològics. Molts enzims, els catalitzadors naturals, són complexos metàl·lics; per exemple, la catalasa, que és un catalitzador eficient per a la descomposició del peròxid d'hidrogen, conté complexos de ferro-porfirina. Els ions metàl·lics coordinats són probablement els llocs d'activitat catalítica dels enzims. L'hemoglobina també conté complexos de ferro-porfirina, el seu paper com a portador d'oxigen està relacionat amb la capacitat dels àtoms de ferro per coordinar les molècules d'oxigen de manera reversible. Altres compostos de coordinació biològicament importants són la clorofil·la (complex magnesi-porfirina) i la vitamina B₁₂, un complex de cobalt amb un lligand macrocíclic.
Les aplicacions dels compostos de coordinació en la indústria són moltes i variades. Els colors brillants i intensos de molts compostos de coordinació, com el blau de Prússia, els fan de gran valor com a colorants i pigments. Els complexos de ftalocianina (per exemple, la ftalocianina de coure), que contenen quelats grans, estretament relacionats amb les porfirines, constitueixen una classe important de colorants per als teixits. En metal·lúrgia el níquel, el cobalt i el coure es poden extreure dels seus minerals com a complexos d'amoníac. La purificació del níquel es pot fer per reacció amb monòxid de carboni per formar el complex volàtil tetracarbonil de níquel, que es pot destil·lar i descompondre tèrmicament per dipositar el metall pur. Les solucions de cianur aquós s'utilitzen normalment per separar l'or d'altres composts. Els complexos de cianur també troben aplicació en electroplàstics.

En química analítica s'empra:
- La precipitació selectiva dels ions metàl·lics com a complexos, per exemple, l'ió níquel(2+) com el complex dimetilglioxima.
- La formació de complexos de colors, com l'ió tetracorocobaltat(2−), que es pot determinar espectrofotomètricament, i
- La preparació de complexos, com els acetilactonats metàl·lics, que es poden separar de solució aquosa per extracció amb dissolvents orgànics.
En determinades circumstàncies, la presència d'ions metàl·lics és indesitjable, és el cas d'aigua amb elevada duresa deguda als cations calci, Ca2+, i magnesi, Mg2+. Sovint poden eliminar-se "segrestant-los" com a complexos emprant, per exemple, l'àcid etilendiamintetracètic (EDTA). Aquest reactiu també s'empra en la preservació de substàncies orgàniques, com els olis vegetals i el cautxú, en aquest cas es combina amb traces d'ions de metalls de transició que catalitzarien l'oxidació de les substàncies orgàniques.
Un desenvolupament tecnològic i científic molt important fou el descobriment el 1954 dels catalitzadors de Ziegler i Natta —una combinació de triclorur de titani, o TiCl₃, i trietilalumini, o Al(C₂H₅)₃— que faciliten les polimeritzacions d'alquens en condicions lleus per formar polímers. Alguns d'aquest són de gran importància comercial perquè s'utilitzen per fabricar molts tipus de fibres, pel·lícules i plàstics. Altres processos d'importància tecnològica basats en catalitzadors de complexos metàl·lics són la catàlisi per carbonils metàl·lics, com la hidridotetracarbonilcobalt, de l'anomenada hidroformilació d'olefines —és a dir, de les seves reaccions amb hidrogen i monòxid de carboni per formar aldehids— i la catàlisi per tetracloropalladate(2−) ions de l'oxidació de l'etilè en solució aquosa a acetaldehid.
Composts organometàl·lics

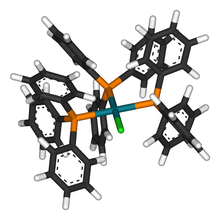
S'anomenen composts organometàl·lics les combinacions en les quals existeix un enllaç entre àtoms d'un metall i àtoms de carboni, corresponents a radicals o a molècules orgàniques. Si bé aquest tipus d'enllaços existeixen en els complexos de coordinació (carbonils i cianurs), la denominació de composts organometàl·lics s'aplica, de manera especial, a les combinacions en les quals els carbonis units a l'àtom de metall formen part de molècules orgàniques (radical etil, ciclopentadienil, anells aromàtics…).
El primer compost organometàl·lic conegut fou el dietilzinc (CH₃—CH₂—Zn—CH₂—CH₃), aïllat el 1849 pel químic anglès Edward Frankland; d'aleshores ençà, hom n'ha sintetitzats un gran nombre, que comprèn gairebé tots els elements metàl·lics.
N'hi ha de dos tipus:
- els organometàl·lics purs, que contenen exclusivament radicals orgànics units al metall, i
- els mixts, que contenen alhora radicals orgànics i inorgànics units al metall.
Des del punt de vista del tipus d'enllaç, poden ésser classificats en:
- iònics, formats únicament pels metalls més electropositius, i
- covalents, entre els quals cal distingir els que presenten enllaços σ i els que presenten enllaços π.
La natura de l'enllaç metall-carboni té una gran influència sobre l'estabilitat d'aquests composts. Així, els iònics i els covalents de tipus σ solen ser tèrmicament inestables i sensibles a l'oxidació i a la hidròlisi, mentre que els covalents de tipus π presenten una estabilitat tèrmica més gran i són en molts casos inerts als agents abans esmentats. Els mètodes de preparació són d'una gran diversitat. Entre els més generals, per a elements dels grups principals, cal esmentar la reacció de derivats halogenats amb metalls, la reacció dels composts formats pel mètode anterior amb un metall o halogenur metàl·lic per a bescanviar el metall i l'addició d'hidrurs metàl·lics sobre dobles enllaços.
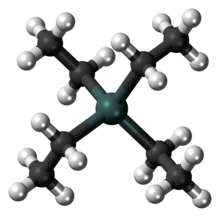
En quant a la seva reactivitat químiques, la presència d'un metall enllaçat a un carboni pot induir en aquest un comportament aniònic, com és el cas dels reactius de Grignard, o catiònic, com passa en els complexos de tipus π de metalls de transició amb alquens, i també pot afavorir la formació de radicals lliures, per exemple en el tetraetilplom. Els complexos de coordinació també experimenten altres reaccions importants, com l'addició oxidant, l'eliminació reductora i transposicions intramoleculars. A més del gran interès teòric que presenten, centrat principalment en l'estudi de l'enllaç metall-carboni, propietats catalítiques i estabilització de molècules orgàniques de gran reactivitat, els composts organometàl·lics troben un gran nombre d'aplicacions en síntesi orgànica i en la indústria química. Des del punt de vista fisiològic, són en molts casos d'una gran toxicitat.
Vegeu també
Referències
- ↑ Cuevas, A. .. Química II. Umbral. ISBN 9685607206.
- ↑ 2,0 2,1 2,2 Enciclopèdia Catalana. L'Enciclopèdia, 1999.
- ↑ 3,0 3,1 Gutiérrez, E. Química inorgànica. Reverté, 1985. ISBN 84-291-7215-7.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 «Compost inorgànic». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 «Coordination compound» (en anglès). Encyclopædia Britannica, 2003.
- ↑ 6,0 6,1 6,2 «Compost inorgànic». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Compost inorgànic |





