Metàstasi
 | |
| Tipus | neoplàsia secundària i neoplàsia |
|---|---|
| Especialitat | oncologia |
| Classificació | |
| CIM-O | 8000/6 |
| Recursos externs | |
| DiseasesDB | 28954 |
| MedlinePlus | 002260 |
| MeSH | D009362 |
| UMLS CUI | C2939420 i C0027627 |
Metàstasi (grec: desplaçament, μετά=següent + στάσις=lloc, plural: metastases) és l'extensió d'una malaltia d'un òrgan o part a un altre òrgan o part, sigui de manera local o a distància. Només els tumors malignes i les infeccions -com la tuberculosi, per exemple, quan forma abscessos gramulomatosos- tenen la capacitat de metastatitzar.
Les cèl·lules canceroses tenen la capacitat de desprendre's o filtrar-se des d'un tumor primari, entrar als vasos limfàtics o sanguinis, circular pel torrent sanguini, i assentar-se i créixer en teixits sans de qualsevol part del cos. La metàstasi és un dels tres signes de malignitat (en contrast amb els tumors benignes). Tot i els avenços terapèutics, les metàstasis segueixen sent la principal causa de mort per càncer. La majoria de neoplàsies poden metastatitzar, encara que en diversos graus, existint només unes poques excepcions, com el glioma que molt rarament es dissemina fora del crani o el carcinoma de cèl·lules basals que mai metastatitza.
Quan les cèl·lules tumorals metastatitzen, el nou tumor s'anomena tumor secundari o metastàtic, i les cèl·lules són histològicament iguals a les del tumor original. Això vol dir que, si per exemple un càncer al pit (càncer de mama) metastatitza (passa) al pulmó, les cèl·lules del tumor secundari seran cèl·lules provinents del tumor al pit. En aquest cas, el tumor s'anomenaria càncer de mama metastàtic i no càncer de pulmó.
Les micrometàstasis són focus de cèl·lules canceroses en els ganglis limfàtics d'almenys 0,2 mm (o 200 cèl·lules), però encara no de més de 2 mm. Són difícils de detectar sense emprar procediments especials. Trobar micrometàstasis ganglionars ajuda a predir el pronòstic i l'evolució del càncer primari.
Fisiopatologia
Els tumors metastàtics són molt comuns en les últimes etapes del càncer, quan aquest no es pot curar o controlar amb cap tractament. La propagació de metàstasis pot produir-se a través de la sang, els limfàtics, les cavitats i superfícies epitelials, els espais celòmics o el líquid cefalorraquidi. Els llocs més freqüents per a les metàstasis que es formen a partir d'un procés cancerós són els pulmons, el fetge, el cervell i els ossos. En casos molt determinats, la cirurgia oncològica pot accelerar el creixement de micrometàstasis.
Factors que intervenen
Sembla que la molècula d'adhesió cel·lular L1 hi tindria un paper rellevant. La pèrdua o l'expressió insuficient de la E-cadherina afavoreix que es formin metàstasis, ja que modifica a la baixa l'activitat de determinats factors de transcripció, entre ells la proteïna twist. La sobreexpressió de la família de proteïnes codificada pel gen NM23-H1/NME1 i els seus homòlegs està relacionada amb l'aptitud per crear metàstasis dels melanomes, els carcinomes hepatocel·lulars els càncers de mama, de colon, d'estómac, d'ovari o de cèrvix.
Els avenços en genòmica han fet possible ampliar molt els coneixements sobre la biologia molecular de les metàstasis. Uns gens regulen l'activitat de les cèl·lules iniciadores del procés metastàtic tumoral, uns altres els trets evolutius de les metàstasis quan han sorgit del càncer primari i un tercer grup influeix en la seva agressivitat i resistència al tractament. Se sap, per exemple, que la proteïna ezrina codificada pel gen EZR situat al cromosoma 6 està implicada en les interaccions entre la membrana plasmàtica i el citoesquelet d'actina i que té activitat tumorigènica. L'expressió d'alts nivells d'aquesta proteïna s'associa amb un comportament metastàtic molt agressiu en diversos tipus de càncer.
L'anàlisi del transcriptoma de les cèl·lules canceroses és una eina que ajuda a identificar els gens i les vies de senyalització que condicionen el divers comportament organotròpic de les metàstasis segons el seu lloc d'origen.
Rutes

Les metàstasis es disseminen per les següents quatre rutes:
Transcelòmica
La disseminació d'una malignitat a les cavitats del cos pot produir-se envaint els espais peritoneals (carcinomatosi peritoneal), pleurals, pericardíacs o subaracnoidals. Per exemple, els tumors ovàrics es poden estendre de manera transperitoneal a la superfície del fetge.
Limfàtica
La disseminació limfàtica permet el transport de cèl·lules tumorals als ganglis limfàtics regionals prop del tumor primari i, finalment, a altres parts del cos. Els tumors primaris malignes alliberen factors de creixement com l'FCEV-C per induir l'expansió dels vasos limfàtics (limfangiogènesi) i dels ganglis sentinella on drenen, un fet que provoca la hiperplàsia sinusal d'aquests ganglis i facilita la identificació oncològica de les metàstasis en fases molt inicials. Les anomenades estructures limfàtiques terciàries són acumulacions ectòpiques de cèl·lules limfoides que es formen dins del teixit no limfoide. Comparteixen característiques estructurals i funcionals amb els ganglis limfàtics. S'ha descrit la seva existència en processos que cursen amb un estat d'inflamació crònica i també en múltiples tipus de càncer sòlid. Es creu que aquestes estructures poden ser un mecanisme alternatiu implicat en l'establiment del nínxol premetastàtic i la posterior metastatització tumoral a distància.
Hematògena
Aquesta és una ruta típica de metàstasi per als sarcomes, però també és la ruta preferida per a determinats tipus de carcinoma, com el carcinoma de cèl·lules renals originat pel ronyó. A causa de les seves parets més primes, les venes són més freqüentment envaïdes que les artèries, i la metàstasi sol seguir el patró del flux venós. És a dir, la disseminació hematògena sovint segueix patrons diferents en funció de la ubicació del tumor primari. Per exemple, el càncer colorectal s'estén principalment a través de la vena porta al fetge i el d'ovari té una clara preferència per l'epipló. El medul·loblastoma, un dels tumors cerebrals malignes pediàtrics més freqüents, combina la seva disseminació cel·lular mitjançant el líquid cefalorraquidi amb la via hematògena per formar metàstasis extraneurals i a l'espai leptomeníngic (entre la piamàter i l'aracnoide).
Canalicular
Alguns tumors, especialment els carcinomes, poden metastatitzar al llarg d'espais anatòmics canaliculars. Aquests espais inclouen, per exemple, els conductes biliars, el sistema urinari, les vies respiratòries i l'espai subaracnoidal.
Galeria
-
Tall coronal d'un húmer mostrant una metàstasi força estesa.
-
Gangli limfàtic amb reemplaçament gairebé complet del seu teixit per la metàstasi d'un melanoma. El pigment marró és la deposició focal de la melanina.
-
Tomografia computada de metàstasis hepàtiques múltiples (imatges arrodonides i més fosques del fetge, situat a l'esquerra de la imatge).
-
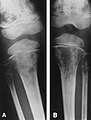
Radiografies de metàstasis bilaterals d'un neuroblastoma a la porció inferior dels fèmurs i superior de les tíbies.
Referències
- ↑ «metàstasi». Diccionari.cat. Grup Enciclopèdia Catalana. .
- ↑ Ramírez-Lapausa, M; Menéndez-Saldaña, A; Noguerado-Asensio, A «Tuberculosis extrapulmonar, una revisión» (en castellà). Rev Esp Sanid Penit, 2015; 17 (1), pp: 3-11. DOI: 10.4321/S1575-06202015000100002. ISSN: 2013-6463. PMID: 25803112 .
- ↑ «metàstasi». DIEC2. Institut Estudis Catalans. .
- ↑ Pernick, N «Tissue of origin/unknown primary tumor» (en anglès). Stains & molecular markers. PathologyOutlines, 2021; Abr 23 (rev), pàgs: 3 .
- ↑ Seyfried, TN; Huysentruyt, LC «On the Origin of Cancer Metastasis» (en anglès). Critical Reviews in Oncogenesis, 2013; 18 (1-2), pp: 43-73. DOI: 10.1615/critrevoncog.v18.i1-2.40. PMC: 3597235. PMID: 23237552 .
- ↑ 6,0 6,1 Kumar, Vinay; Abbas, Abul K.; Nelson, Fausto. Robbins and Cotran pathologic basis of disease. 7a ed. Filadèlfia: Elsevier Saunders, 2005. ISBN 978-0-7216-0187-8.
- ↑ Ganesh, K; Massagué, J «Targeting metastatic cancer» (en anglès). Nat Med, 2021 Gen; 27 (1), pp: 34-44. DOI: 10.1038/s41591-020-01195-4. PMC: 7895475. PMID: 33442008 .
- ↑ Sun, Q; Xu, R; Xu, H; Wang, G; Shen, X; Jiang, H «Extracranial metastases of high-grade glioma: the clinical characteristics and mechanism» (en anglès). World J Surg Oncol, 2017 Oct 6; 15 (1), pp: 181. DOI: 10.1186/s12957-017-1249-6. PMC: 5639596. PMID: 28985756 .
- ↑ Jin, L; Han, B; Siegel, E; Cui, Y; Giuliano, A; Cui, X «Breast cancer lung metastasis: Molecular biology and therapeutic implications» (en anglès). Cancer Biol Ther, 2018; 19 (10), pp: 858-868. DOI: 10.1080/15384047.2018.1456599. PMC: 6300341. PMID: 29580128 .
- ↑ Chuang, WY; Chen, CC; Yu, WH; Yeh, CJ; Ueng, SH; et al «Identification of nodal micrometastasis in colorectal cancer using deep learning on annotation-free whole-slide images» (en anglès). Mod Pathol, 2021 Oct; 34 (10), pp: 1901-1911. DOI: 10.1038/s41379-021-00838-2. PMC: 8443445. PMID: 34103664 .
- ↑ Gobardhan, PD; Elias, SG; Madsen, EVE; van Wely, B; van den Wildenberg, F; Theunissen, EBM; Ernst, MF; et al «Prognostic value of lymph node micrometastases in breast cancer: a multicenter cohort study» (en anglès). Ann Surg Oncol, 2011 Jun; 18 (6), pp: 1657-1664. DOI: 10.1245/s10434-010-1451-z. PMC: 3087878. PMID: 21153885 .
- ↑ Medical and Editorial content Team. «Understanding Advanced and Metastatic Cancer» (en anglès) pàgs: 28. Treatment & Support, American Cancer Society, 2020; Set 10 (rev). .
- ↑ Morgan-Parkes, JH «Metastases: mechanisms, pathways, and cascades» (en anglès). AJR Am J Roentgenol, 1995 Maig; 164 (5), pp: 1075-1082. DOI: 10.2214/ajr.164.5.7717206. ISSN: 1546-3141. PMID: 7717206 .
- ↑ Gerull, WD; Puri, V; Kozower, BD «The epidemiology and biology of pulmonary metastasis» (en anglès). J Thorac Dis, 2021 Abr; 13 (4), pp: 2585-2589. DOI: 10.21037/jtd.2020.04.28. PMC: 8107531. PMID: 34012606 .
- ↑ Tholey, D «Metastatic Liver Cancer» (en anglès). MSD Manual (Professional Version). Merck Sharp & Dohme Corp, 2020; Abr (rev), pàgs: 3 .
- ↑ Amsbaugh, MJ; Kim, SC «Brain Metastasis» (en anglès). StatPearls . StatPearls Publishing LLC, 2020 Jun 30; NBK470246 (rev), pàgs: 6. PMID: 29262201 .
- ↑ National Cancer Institute. «Metastatic Cancer: Questions and Answers» (en anglès) pàgs: 5. Cancer Facts. NIH, US Department of Health and Human Services, 2004; Set 1 (rev). Arxivat de l'original el 2006-09-23. .
- ↑ D'Oronzo, S; Coleman, R; Brown, J; Silvestris, F «Metastatic bone disease: Pathogenesis and therapeutic options: Up-date on bone metastasis management» (en anglès). J Bone Oncol, 2018 Nov 6; 15, pp: 004-4. DOI: 10.1016/j.jbo.2018.10.004. PMC: 6429006. PMID: 30937279 .
- ↑ Tohme, S; Simmons, RL; Tsung, A «Surgery for Cancer: A Trigger for Metastases» (en anglès). Cancer Res, 2017 Abr 1; 77 (7), pp: 1548-1552. DOI: 10.1158/0008-5472.CAN-16-1536. PMC: 5380551. PMID: 28330928 .
- ↑ Ganesh, K; Basnet, H; Kaygusuz, Y; Laughney, AM; He, L; Sharma, R; O'Rourke, KP; Reuter, VP; et al «L1CAM defines the regenerative origin of metastasis-initiating cells in colorectal cancer». Nature Cancer, 1, 1, 13-01-2020, pp: 28–45. DOI: 10.1038/s43018-019-0006-x. ISSN: 2662-1347. PMID: 32656539 .
- ↑ Okegawa, T; Pong, RC; Li, Y; Hsieh, JT «The role of cell adhesion molecule in cancer progression and its application in cancer therapy» (en anglès). Acta Biochim Pol, 2004; 51 (2), pp: 445-457. ISSN: 1734-154X. PMID: 15218541 .
- ↑ Onder, TT; Gupta, PB; Mani, SA; Yang, J; et al «Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways» (en anglès). Cancer Res, 2008 Maig 15; 68 (10), pp: 3645-3654. DOI: 10.1158/0008-5472.CAN-07-2938. ISSN: 1538-7445. PMID: 18483246 .
- ↑ UniProt «NME1, Nucleoside diphosphate kinase A» (en anglès). Protein knowledgebase. UniProt Consortium, 2022 Feb 23; P15531 -NDKA_HUMAN- (rev), pàgs: 16 .
- ↑ Mátyási, B; Farkas, Z; Kopper, L; Sebestyén, A; Boissan, M; et al «The Function of NM23-H1/NME1 and Its Homologs in Major Processes Linked to Metastasis» (en anglès). Pathol Oncol Res, 2020 Gen; 26 (1), pp: 49-61. DOI: 10.1007/s12253-020-00797-0. PMC: 7109179. PMID: 31993913 .
- ↑ Yan, J; Huang, Q «Genomics screens for metastasis genes» (en anglès). Cancer Metastasis Rev, 2012 Des; 31 (3-4), pp: 419-428. DOI: 10.1007/s10555-012-9362-z. PMC: 4071451. PMID: 22684367 .
- ↑ Celià-Terrassa, T; Kang, Y «Distinctive properties of metastasis-initiating cells» (en anglès). Genes & Development, 2016 Abr 15; 30 (8), pp: 892-908. DOI: 10.1101/gad.277681.116. PMC: 4840296. PMID: 27083997 .
- ↑ Vanharanta, S; Massagué, J «Origins of metastatic traïts» (en anglès). Cancer Cell, 2013 Oct 14; 24 (4), pp: 410-421. DOI: 10.1016/j.ccr.2013.09.007. PMC: 3998120. PMID: 24135279 .
- ↑ Dembic, Z «Antitumor Drugs and Their Targets» (en anglès). Molecules, 2020 Des 7; 25 (23), pp: 5776. DOI: 10.3390/molecules25235776. PMC: 7730053. PMID: 33297561 .
- ↑ UniProt «Ezrin - EZR» (en anglès). Protein knowledgebase. UniProt Consortium, 2021 Set 29; P15311 -EZRI_HUMAN- (rev), pàgs: 17 .
- ↑ Song, Y; Ma, X; Zhang, M; Wang, M; Wang, G; et al «Ezrin Mediates Invasion and Metastasis in Tumorigenesis: A Review» (en anglès). Front Cell Dev Biol, 2020 Nov 10; 8, pp: 588801. DOI: 10.3389/fcell.2020.588801. PMC: 7683424. PMID: 33240887 .
- ↑ Zhang, L; Fan, M; Napolitano, F; Gao, X; et al «Transcriptomic analysis identifies organ-specific metastasis genes and pathways across different primary sites» (en anglès). J Transl Med, 2021 Gen 7; 19 (1), pp: 31. DOI: 10.1186/s12967-020-02696-z. PMC: 7791985. PMID: 33413400 .
- ↑ Roth, L; Russo, L; Ulugoel, S; Freire Dos Santos, R; Breuer, E; et al «Peritoneal Metastasis: Current Status and Treatment Options» (en anglès). Cancers (Basel), 2021 Des 23; 14 (1), pp: 60. DOI: 10.3390/cancers14010060. PMC: 8750973. PMID: 35008221 .
- ↑ Karaman, S; Detmar, M «Mechanisms of lymphatic metastasis» (en anglès). J Clin Invest, 2014 Mar; 124 (3), pp: 922-928. DOI: 10.1172/JCI71606. PMC: 3938272. PMID: 24590277 .
- ↑ Liersch, R; Hirakawa, S; Berdel, WE; Mesters, RM; Detmar, M «Induced lymphatic sinus hyperplasia in sentinel lymph nodes by VEGF-C as the earliest premetastatic indicator» (en anglès). Int J Oncol, 2012 Des; 41 (6), pp: 2073-2078. DOI: 10.3892/ijo.2012.1665. PMC: 3583645. PMID: 23076721 .
- ↑ Lin, Z; Huang, L; Li, S; Gu, J; Cui, X; Zhou, Y «Pan-cancer analysis of genomic properties and clinical outcome associated with tumor tertiary lymphoid structure» (en anglès). Sci Rep, 2020 Des 9; 10 (1), pp: 21530. DOI: 10.1038/s41598-020-78560-3. PMC: 7725838. PMID: 33299035 .
- ↑ Mustapha, R; Ng, K; Monypenny, J; Ng, T «Insights Into Unveiling a Potential Role of Tertiary Lymphoid Structures in Metastasis» (en anglès). Front Mol Biosci, 2021 Set 8; 8, pp: 661516. DOI: 10.3389/fmolb.2021.661516. PMC: 8455920. PMID: 34568423 .
- ↑ Cheng, SKH; Chuah, KL «Metastatic Renal Cell Carcinoma to the Pancreas: A Review» (en anglès). Arch Pathol Lab Med, 2016 Jun; 140 (6), pp: 598-602. DOI: 10.5858/arpa.2015-0135-RS. ISSN: 1543-2165. PMID: 27232353 .
- ↑ Kow, AWC «Hepatic metastasis from colorectal cancer» (en anglès). J Gastrointest Oncol, 2019 Des; 10 (6), pp: 1274-1298. DOI: 10.21037/jgo.2019.08.06. PMC: 6955002. PMID: 319499 FZ;48 .
- ↑ Pradeep, S; Kim, SW; Wu, SY; Nishimura, M; Chaluvally-Raghavan, P; Miyake, T; Pecot, CV; Kim, SJ; Choi, HJ; Bischoff, FZ; Mayer, JA; Huang, L; et al «Hematogenous metastasis of ovarian cancer: rethinking mode of spread» (en anglès). Cancer Cell, 2014 Jul 14; 26 (1), pp: 77-91. DOI: 10.1016/j.ccr.2014.05.002. PMC: 4100212. PMID: 25026212 .
- ↑ Mahapatra, S; Amsbaugh, MJ «Medulloblastoma» (en anglès). StatPearls . StatPearls Publishing LLC, 2021 Jul 2; NBK431069 (rev), pàgs: 11. PMID: 28613723 .
- ↑ Garzia, L; Kijima, N; Morrissy, AS; De Antonellis, P; Guerreiro-Stucklin, A; Holgado, BL; Wu, X; Wang, X; Parsons, M; Zayne, K; Manno, A; Kuzan-Fischer, C; Nor, C; Donovan, LK; Nick, AM; et al «A Hematogenous Route for Medulloblastoma Leptomeningeal Metastases» (en anglès). Cell, 2018 Feb 22; 172 (5), pp: 1050-1062.e14. DOI: 10.1016/j.cell.2018.01.038. PMC: 6346737. PMID: 29474906 .
- ↑ Voss, JN; Nkwam, NM; McCulloch, TA; Mann, GS «Collecting Duct Carcinoma With Cardiac Metastases: A Case Report & Literature Review» (en anglès). Urol Case Rep, 2016 Feb 2; 5, pp: 27-30. DOI: 10.1016/j.eucr.2015.12.010. PMC: 4776230. PMID: 26977410 .
Bibliografia
- Cano Ballesteros, Sara. Metástasis: una perspectiva molecular (en castellà). Encuentros en la Biologia, UMA, Estiu 2012; 5 (138-139), pp: 37-39. ISSN 2254-0296 . Arxivat 23 de novembre 2018 a Wayback Machine.
- Peinado, Héctor; Zhang, Haiying; Matei, Irina R.; Costa-Silva, Bruno; et al. Pre-metastatic niches: organ-specific homes for metastases (en anglès). Nat Rev Cancer, 2017 Maig; 17 (5), pp: 302-317. PMID: 28303905. DOI 10.1038/nrc.2017.6 .
- Bhattacharya, Rittwika; Panda, Chinmay Kumar; Nandi, Sourav; Mukhopadhyay, Ashis. An insight into metastasis: Random or evolving paradigms? (en anglès). Pathol Res Pract, 2018 Ag; 214 (8), pp: 1064-1073. PMID: 30078401. DOI 10.1016/j.prp.2018.06.017 .
- Qiu, Zhaoping; Wang, Jianlin; Wu, Yadi. The Landscape of Histone Modification in Cancer Metastasis (en anglès). A: Cancer Metastasis, Chap. 4 (Basbinar Y, Calıbası-Kocal G; Eds.) IntechOpen, 2018; Nov 5, pàgs: 90. ISBN 978-1-78984-633-1. DOI 10.5772/intechopen.78383 .
- Sánchez, Nilda C.; Medrano-Jiménez, Elisa; Aguilar-León, Diana; Pérez-Martínez, Leonor; Pedraza-Alva, Gustavo. Tumor Necrosis Factor-Induced miR-146a Upregulation Promotes Human Lung Adenocarcinoma Metastasis by Targeting Merlin (en anglès). DNA Cell Biol, 2020 Mar; 39 (3), pp: 484-497. PMID: 31999471. DOI 10.1089/dna.2019.4620 .
- Fares, Jawad; Fares, Mohamad Y.; Khachfe, Hussein H.; Salhab, Hamza A.; Fares, Youssef Molecular principles of metastasis: a hallmark of cancer revisited (en anglès). Signal Transduct Target Ther, 2020 Mar 12; 5 (1), pp: 28. PMID: 32296047. DOI 10.1038/s41392-020-0134-x .
- Winkler, Juliane; Abisoye-Ogunniyan, Abisola; Metcalf, Kevin J.; Werb, Zena. Concepts of extracellular matrix remodelling in tumour progression and metastasis (en anglès). Nat Commun, 2020 Oct 9; 11 (1), pp: 5120. PMID: 33037194. DOI 10.1038/s41467-020-18794-x .
- Conod, Arwen; Silvano, Marianna; Ruiz i Altaba, Ariel. On the origin of metastases: Induction of pro-metastatic states after impending cell death via ER stress, reprogramming, and a cytokine storm (en anglès). Cell Reports, 2022 Mar 8; 38 (10), pp: 110490. PMID: 35263600. DOI 10.1016/j.celrep.2022.110490 .
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Metàstasi |
- Metastatic Cancer: When Cancer Spreads NCI/NIH. US Department of Health and Human Services; 2020 Nov (anglès)
- Cèl·lules Mare Canceroses i Dinàmiques de Metàstasi Celià Terrassa, T. Programes de recerca de l'Institut Hospital del Mar d'Investigacions Mèdiques; 2022 Gen