Alkan
I dagens verden er Alkan blevet et relevant emne af interesse for et bredt spektrum af samfundet. Hvad enten det skyldes dets indflydelse på økonomien, politik, kultur eller folks dagligdag, er Alkan et problem, der ikke går ubemærket hen. Efterhånden som verden udvikler sig og udvikler sig, bliver Alkan mere og mere relevant, og der er behov for at forstå dens implikationer i forskellige aspekter af livet. I denne artikel vil vi grundigt udforske Alkan og dens mange facetter og analysere dens betydning og indflydelse i nutidens verden.
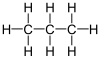
En alkan er en organisk, kemisk forbindelse der består af et antal carbon-atomer bundet til hinanden med enkeltbindinger, så de danner en kæde eller et træ. Alle de resterende valenselektroner på kulstofatomerne binder brint-atomer til molekylet. Et alkan-molekyle med n kædeforbundne kulstofatomer har dermed 2 · n + 2 brintatomer, så bruttoformlen er CnH2·n+2.
En alkyl eller alkylgruppe er en funktionel gruppe eller sidekæde, der, ligesom en alkan, består udelukkende af enkeltbundne kulstofatomer og hydrogenatomer, fx en methyl- eller ethylgruppe.
Teoretisk set findes der en kemisk forbindelse for ethvert naturligt tal n, og på grund af fællestrækket i deres opbygning, kategoriserer man alle disse forbindelser under navnet alkaner. Bortset fra de fire simpleste har alle alkaner navne efter det græske udtryk for antallet af kulstofatomer, efterfulgt af endelsen -"an". Navnet for de første 12 alkaner er vist i tabellen nedenfor.
| Antal C-atomer |
Navn | Molekylformel |
|---|---|---|
| 1 | Methan | CH4 |
| 2 | Ethan | C2H6 |
| 3 | Propan | C3H8 |
| 4 | Butan | C4H10 |
| 5 | Pentan | C5H12 |
| 6 | Hexan | C6H14 |
| 7 | Heptan | C7H16 |
| 8 | Octan | C8H18 |
| 9 | Nonan | C9H20 |
| 10 | Decan | C10H22 |
| 11 | Undecan | C11H24 |
| 12 | Dodecan | C12H26 |
Carbon og Hydrogen sammenhængen kan skrives som CnH2n+2.
Egenskaber og anvendelser
De første fire alkaner i ovenstående liste er på gasform ved normalt tryk og temperatur. De næste er flydende, og jo længere molekylerne bliver, desto mere tyktflydende bliver de. Plastmaterialet polyetylen kan betragtes som en "blandet samling" af alkaner med ti- eller hundredetusindvis af kulstofatomer i kæderne.
Methan bliver ofte brugt som brændsel til fx gasbrændere. når Methan brændes dannes der kuldioxid og vand. dette sker ved denne kemiske reaktion:
CH4 + 2 O2 → CO2 + 2 H2O
hvis der ikke er ilt nok til at lave CO2 kan der i stedet blive dannet CO også kaldet kulilte.
Stofferne heptan og oktan er to af mange forskellige kulbrinteforbindelser der findes i benzin, og oktan-tallet for benzin beskriver hvilken blanding af netop heptan og oktan, nærmere bestemt n-heptan (uforgrenet kulstofkæde) med oktantallet 0, og iso-oktan (2,2,4-trimethyl-pentan) med oktantallet 100, der har samme egenskaber (mht. antændelsespunkt) som pågældende benzin. En blanding af fx 5% n-heptan og 95% iso-oktan har oktantallet 95.
- Find den længste kæde (hovedkæden) og navngiv den.
- Find og navngiv sidekæder. Husk, at de ender på -yl fx methyl.
- Hvis der er to ens sidekæder skrives di- foran fx dimethyl. Ved tre ens skrives tri- osv.
- Nummerér C-atomerne i den længste kæde. De C-atomer, som sidekæderne er bundet til, skal have så lavt et nummer (placeringstal) som muligt.
- Det endelige navn skrives således: placeringstal – sidekædenavn, hovedkædenavn.
- Hvis der er flere forskellige sidekæder, skrives de i alfabetisk rækkefølge.
Se også
Eksterne henvisninger
- Basiskemi C bog: "Carbonhydrider" Arkiveret 13. juli 2019 hos Wayback Machine
 |
Wikimedia Commons har medier relateret til: |