Bisulfito
En el marco de Bisulfito, nos encontramos con un tema de gran relevancia e interés en la actualidad. Este tema ha generado debates, discusiones y reflexiones en diferentes ámbitos, desde la política hasta la ciencia, pasando por la cultura y la sociedad en general. Es un tema que nos invita a reflexionar sobre aspectos fundamentales de la vida, a cuestionar nuestras creencias y a buscar respuestas a preguntas que nos han acompañado a lo largo de la historia. A través de este artículo, buscaremos adentrarnos en Bisulfito, explorando sus diferentes facetas, analizando sus implicaciones y ofreciendo una mirada crítica y analítica sobre un tema que nos concierne a todos.
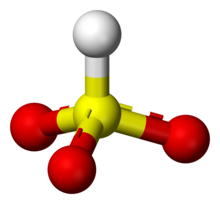
El ion bisulfito (nomenclatura recomendada por IUPAC: sulfito ácido) es el ion HSO3-. Las sales que contienen el ion HSO3- se denominan bisulfitos también conocidos como lejías de sulfito. Por ejemplo, el bisulfito de sodio es NaHSO3.
Estructura

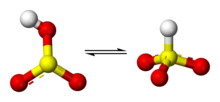
Alguna evidencia puede sugerir que el protón en el ion bisulfito se encuentra en azufre, dando lugar a la simetría de C3v. Hay, sin embargo, alguna evidencia de espectroscopia 17O RMN que sugiere dos formas tautoméricas HSO3- que existen en equilibrio dinámico, uno que tiene el protón unido a azufre (HSO3-) y uno que está protonado el oxígeno (HOSO2-). La estructura C3v está soportada por cristalografía de rayos X y, en solución acuosa, por espectroscopía Raman (ν (S – H) = 2500 cm−1).
Reacciones
Las sales de bisulfito se preparan típicamente por tratamiento de soluciones alcalinas con exceso de dióxido de azufre
- SO2 + NaOH → NaHSO3
HSO3- es la base conjugada del ácido sulfuroso, H2SO3:
- H2SO3 ⇌ HSO3− + H+
El ácido sulfuroso no es un compuesto aislable y tampoco parece existir en solución. Se da un equilibrio que es mucho más consistente con la evidencia espectroscópica. :
- SO2 + H2O ⇌ HSO3− + H+
HSO3- es una especie ácida débil con una pKa de 6.97. Su base conjugada es el ion sulfito, SO32−:
- HSO3− ⇌ SO32− + H+
Los bisulfitos son agentes reductores, como lo son todos los sulfitos y el dióxido de azufre, que contiene azufre en el mismo estado de oxidación (+4).
Medicina
Las sales de bisulfito son aditivos comunes a la epinefrina del fármaco para evitar su oxidación a adrenocromo y la inactivación resultante. Los bisulfitos a veces pueden causar una reacción alérgica. Esto es diferente de la alergia común a las sulfamidas. Fraser y Huang han determinado la cantidad de bisulfito en los bloqueadores médicos del dolor que inicia la hipersensibilidad de tipo 1.
Véase también
Referencias
- ↑ Horner, D. A.; Connick, R. E. (1986). «Equilibrium quotient for the isomerization of bisulfite ion from HSO3− to SO3H−». Inorganic Chemistry 25 (14): 2414-2417. doi:10.1021/ic00234a026.
- ↑ Fraser, W. A.; Huang, A. S. (1984). «Are sulfites additives really safe?». New England Journal of Medicine 311 (8): 542. doi:10.1056/NEJM198408233110824.