Sulfamide
Sulfamide est un sujet qui a retenu l'attention de nombreuses personnes ces dernières années. Depuis son émergence, elle a suscité de nombreux débats et fait l’objet de nombreuses études et recherches. Son impact sur la société et la vie quotidienne est indéniable et sa pertinence s’étend à une variété de secteurs et d’aspects. Dans cet article, nous explorerons les différents aspects liés à Sulfamide, en analysant son importance, ses implications et son influence dans le monde d'aujourd'hui. De son histoire à ses possibles développements futurs, nous embarquerons dans un voyage pour en découvrir davantage sur Sulfamide et son rôle dans notre réalité.
| Sulfamide | |
 Structure du sulfamide |
|
| Identification | |
|---|---|
| Nom UICPA | Sulfamide |
| Synonymes |
Diamine sulfurique, sulfamamide, sulfurylamide |
| No CAS | |
| No ECHA | 100.029.330 |
| No CE | 232-262-9 |
| SMILES | |
| Apparence | Solide cristallin blanc |
| Propriétés chimiques | |
| Formule | H4N2O2S SO2(NH2)2 |
| Masse molaire | 96,109 ± 0,006 g/mol H 4,19 %, N 29,15 %, O 33,29 %, S 33,36 %, |
| Propriétés physiques | |
| T° fusion | 93 °C |
| T° ébullition | 250 °C (décomposition) |
| Solubilité | soluble dans l'eau |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfamide, également appelé amide sulfurique, est un composé chimique de formule SO2(NH2)2. C'est un solide blanc, cristallisé dans le système orthorhombique.
On prépare le sulfamide en faisant réagir de l'ammoniac avec du chlorure de sulfuryle.
Groupe fonctionnel sulfamide
En chimie organique, le terme sulfamide peut également renvoyer au groupe fonctionnel formé par une chaîne organique liée à l'un des atomes d'azote du sulfamide. Ce sont les sulfamidés. Les sulfamides symétriques peuvent être préparés directement à partir d'amines et de dioxyde de soufre SO2 gazeux :
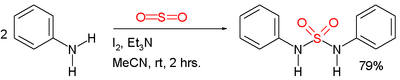
Préparation de sulfonamide à partir d'aniline et de dioxyde de soufre.
Dans cet exemple, les réactifs sont l'aniline, la triéthylamine et l'iode. On pense que le dioxyde de soufre est activé par une série d'intermédiaires : Et3N+SO2−, Et3N-I+I− et Et3N+SO2−.
Référence
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Sulfamides and sulfamide polymers directly from sulfur dioxide Alexander V. Leontiev, H. V. Rasika Dias and Dmitry M. Rudkevich Chem. Commun., 2006, 2887 - 2889, DOI 10.1039/b605063h
