Cubano
Nell'articolo di oggi esploreremo l'affascinante mondo di Cubano. Dalle sue origini fino alla sua attualità, Cubano è stato oggetto di interesse e dibattito in diversi ambiti. Nel corso della storia, Cubano ha svolto un ruolo fondamentale in varie culture e società, influenzando il modo in cui le persone percepiscono il mondo che le circonda. Attraverso un'analisi dettagliata, esamineremo i diversi aspetti che rendono Cubano un argomento meritevole di studio e riflessione. Allo stesso modo, esploreremo le implicazioni e le applicazioni che Cubano ha nella nostra vita quotidiana, fornendo una visione completa e arricchente di questo affascinante argomento.
| Cubano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Pentacicloottano | |
| Nomi alternativi | |
| Prismano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H8 |
| Massa molecolare (u) | 104,15 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| PubChem | 136090 |
| SMILES | C12C3C4C1C5C2C3C45 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,29 |
| Temperatura di fusione | 133,5 °C (406,7 K) |
| Temperatura di ebollizione | 161,5 °C (a 200 °C si decompone) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 144 kcal/mol (602 kJ/mol) |
| Indicazioni di sicurezza | |
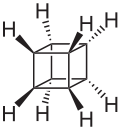
Il cubano è un idrocarburo pentaciclico alifatico avente formula C8H8 o (CH)8. Deve il suo nome al fatto che gli 8 atomi dello scheletro di carbonio sono disposti ai vertici di un cubo. In quanto tale, fa parte degli idrocarburi platonici, insieme al tetraedrano (finora non noto, ma se ne conoscono alcuni derivati) e al dodecaedrano. È il più semplice idrocarburo con simmetria ottaedrica, gruppo puntuale Oh.
Prima della sua sintesi, realizzata ad opera di P. Eaton e T. Cole nel 1964, Eaton credette che il cubano non avrebbe potuto essere ottenuto a causa della necessaria presenza di angoli di legame di 90° che avrebbero comportato grande tensione angolare nella molecola.
Il cubano rappresenta anche un caso particolare degli prismani, il prismano, omologo superiore del prismano (ossia, il benzene di Ladenburg).
Struttura
Nello scheletro della molecola del cubano (come pure in quelli dei suoi derivati) 3 dei 4 angoli di legame di ogni atomo di carbonio sono necessariamente di 90°, valore molto distante da quello dell'angolo tetraedrico (109,5°), che è quello naturale per l'ibridazione sp3. Inoltre, ognuno degli 8 idrogeni, situati sui prolungamenti delle diagonali del cubo, è eclissato. La tensione d'anello che ne risulta, somma delle tensioni angolare e torsionale (o di eclissamento), è di entità veramente notevole: è stata valutata in 154,7 kcal/mol (19,3 kcal/mol per ogni unità CH); quella del ciclobutano, per confronto, ammonta a 26,5 kcal/mol (6,62 kcal/mol per ogni unità CH2, cioè solo un terzo, circa), mentre quella del tetraedrano è stimata in 140 kcal/mol (35 kcal/mol per ogni unità CH).
Tramite indagini di diffrazione elettronica in fase gassosa si è visto che i legami C−C sono lunghi 157,27 ± 0,19 pm, più del valore normale di 154 pm, ma maggiore anche di quelli nel ciclobutano (155,1 pm); anche i legami C−H (111,8 ± 0,8 pm) sono più lunghi rispetto a quelli del ciclobutano (109 pm).
Proprietà
A temperatura e pressione ambiente il cubano è un solido cristallino polimorfico, incolore, ed eccezionalmente denso, per essere un idrocarburo (1,29 g/cm³); è solubile in esano ed altri solventi idrocarburici. Il solido fonde a 133,5 °C e bolle a 161,6 °C. L'alta densità implica anche alta densità di energia sviluppata nella sua combustione rispetto ad altri idrocarburi.
Con la sua tensione d'anello, non sorprende che il cubano sia un idrocarburo fortemente endotermico, ΔHƒ° = +542 ± 3 kJ/mol, quindi termodinamicamente molto instabile, anche se mostra una notevole stabilità cinetica. Infatti, nonostante la molecola sia così fortemente in tensione, il cubano appare insolitamente stabile termicamente: si decompone solo a partire da circa 200 °C, ben oltre la temperatura di ebollizione, dando principalmente l'isomero cicloottatetraene.
Questo è dovuto al fatto che anche l'energia di attivazione per l'isomerizzazione è relativamente alta, 180,5 kJ/mol. Il cubano risulta relativamente stabile anche alla luce, all'aria e all'acqua, per cui è maneggiabile in laboratorio chimico sotto cappa aspirante senza ulteriori particolari limitazioni, tranne ovviamente quelle relative alla sicurezza.
Trattato con catalizzatori a base di Ag(I) o Pd(II) si isomerizza a cuneano. Con catalizzatore a base di Rh(I) si trasforma inizialmente in sin-tricicloottadiene il quale, se scaldato a 50 - 60 °C, si converte poi a ciclottatetraene.
A causa del surplus di energia nella molecola, il cubano e suoi derivati trovano occasionalmente applicazioni come additivi per carburanti o esplosivi ad elevata densità (per il cubano il calore di combustione ammonta a ben 4.833,27 kJ/mol). Uno degli esplosivi di ultima generazione è l'ottanitrocubano ed ha una velocità di esplosione di circa 10.000 m/s.
In connessione alla stabilità della sua struttura a temperatura ambiente e della relativa bassa tossicità, alcuni suoi derivati sono anche oggetto di ricerca in medicina, per applicazioni ottiche e nelle nanotecnologie.
Sintesi
Il cubano è un idrocarburo sintetico, la sua molecola è stata sintetizzata nel 1964 da Philip E. Eaton e Thomas W. Cole dell'Università di Chicago. La sintesi include l'utilizzo di due riarrangiamenti di Favorskii. Fino ad allora si era pensato che l'esistenza di molecole del genere potesse essere solo teorica e che la loro sintesi fosse impossibile per via dell'instabilità indotta dal forzare atomi di carbonio sp3 (vedi: cicloalcani) a formare legami ad angolo retto. Una possibile sintesi del cubano è illustrata nello schema seguente:

Note
- ^ (EN) Kyle F. Biegasiewicz, Justin R. Griffiths e G. Paul Savage, Cubane: 50 Years Later, in Chemical Reviews, vol. 115, n. 14, 22 luglio 2015, pp. 6719–6745, DOI:10.1021/cr500523x. URL consultato il 15 maggio 2022.
- ^ Hopf 2000
- ^ Law 2017, p. 1630.
- ^ CCCBDB listing of experimental geometry data page 2, su cccbdb.nist.gov. URL consultato il 24 gennaio 2023.
- ^ a b (EN) Philip E. Eaton e Thomas W. Cole, Cubane, in Journal of the American Chemical Society, vol. 86, n. 15, 1964-08, pp. 3157–3158, DOI:10.1021/ja01069a041. URL consultato il 24 gennaio 2023.
- ^ John W. Moore, Conrad L. Stanitski e Peter C. Jurs, Chemistry: the molecular science, Harcourt College Publishers, 2002, ISBN 978-0-03-032011-8.
- ^ (EN) Harry P. Schultz, Topological Organic Chemistry. Polyhedranes and Prismanes, in The Journal of Organic Chemistry, vol. 30, n. 5, 1965-05, pp. 1361–1364, DOI:10.1021/jo01016a005. URL consultato il 18 aprile 2022 (archiviato il 12 gennaio 2021).
- ^ Raimondo Germani, Molecole dalla forma curiosa (PDF), 2018. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ F. A. Carey e R. J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms, Fifth Edition, Springer Science+Business Media, LLC, 2007, p. 88, ISBN 978-0-387-68346-1.
- ^ diffrazione di elettroni in "Enciclopedia della Scienza e della Tecnica", su treccani.it. URL consultato il 23 aprile 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ (EN) Lise Hedberg, Kenneth Hedberg e Philip E. Eaton, Bond lengths and quadratic force field for cubane, in Journal of the American Chemical Society, vol. 113, n. 5, 1991-02, pp. 1514–1517, DOI:10.1021/ja00005a007. URL consultato il 18 aprile 2022.
- ^ (EN) Norman L. Allinger e Philip E. Eaton, The geometries of pentaprismane and hexaprismane insights from molecular mechanics, in Tetrahedron Letters, vol. 24, n. 35, 1º gennaio 1983, pp. 3697–3700, DOI:10.1016/S0040-4039(00)94512-X. URL consultato il 18 aprile 2022.
- ^ (EN) Norman L. Allinger, Conformational analysis. 130. MM2. A hydrocarbon force field utilizing V1 and V2 torsional terms, in Journal of the American Chemical Society, vol. 99, n. 25, 1977-12, pp. 8127–8134, DOI:10.1021/ja00467a001. URL consultato il 18 aprile 2022 (archiviato il 9 aprile 2022).
- ^ (EN) Mary Anne White, Roderick E. Wasylishen e Philip E. Eaton, Orientational disorder in solid cubane: a thermodynamic and carbon-13 NMR study, in The Journal of Physical Chemistry, vol. 96, n. 1, 1992-01, pp. 421–425, DOI:10.1021/j100180a078. URL consultato il 18 aprile 2022 (archiviato l'11 dicembre 2020).
- ^ (EN) Philip E. Eaton, Cubanes: Starting Materials for the Chemistry of the 1990s and the New Century, in Angewandte Chemie International Edition in English, vol. 31, n. 11, 1992-11, pp. 1421–1436, DOI:10.1002/anie.199214211. URL consultato il 24 gennaio 2023.
- ^ Start, su ch.ic.ac.uk. URL consultato il 24 gennaio 2023.
- ^ (EN) Kyle F. Biegasiewicz, Justin R. Griffiths e G. Paul Savage, Cubane: 50 Years Later, in Chemical Reviews, vol. 115, n. 14, 22 luglio 2015, pp. 6719–6745, DOI:10.1021/cr500523x. URL consultato il 18 aprile 2022 (archiviato il 28 novembre 2021).
- ^ a b High energy derivatives of Cubane, su archive.wikiwix.com. URL consultato il 24 gennaio 2023.
- ^ a b B. D. Kybett, S. Carroll e P. Natalis, Thermodynamic properties of cubane, vol. 88, 1966, pp. 626. URL consultato il 7 agosto 2023.
- ^ (EN) Hans-Dieter Martin, Thomas Urbanek e Peter Pföhler, The pyrolysis of cubane; an example of a thermally induced hot molecule reaction, in J. Chem. Soc., Chem. Commun., n. 14, 1985, pp. 964–965, DOI:10.1039/C39850000964. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ (EN) Ahmad Seif, Luis R. Domingo e Ehsan Zahedi, Unraveling the kinetics and molecular mechanism of gas phase pyrolysis of cubane to annulene, in RSC Advances, vol. 10, n. 54, 2020, pp. 32730–32739, DOI:10.1039/D0RA05371F. URL consultato il 18 aprile 2022 (archiviato il 19 aprile 2022).
- ^ (DE) Philip E. Eaton, Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts, in Angewandte Chemie, vol. 104, n. 11, 1992-11, pp. 1447–1462, DOI:10.1002/ange.19921041105. URL consultato il 18 aprile 2022 (archiviato il 19 febbraio 2022).
- ^ Nome sistematico: Pentacicloottano
- ^ (EN) Philip E. Eaton, Luigi Cassar e Jack Halpern, Silver(I)- and palladium(II)-catalyzed isomerizations of cubane. Synthesis and characterization of cuneane, in Journal of the American Chemical Society, vol. 92, n. 21, 1970-10, pp. 6366–6368, DOI:10.1021/ja00724a061. URL consultato il 18 aprile 2022 (archiviato il 29 ottobre 2020).
- ^ (EN) Tricyclo[4.2.0.0(2,5)]octa-3,7-diene, (1α,2α,5α,6α),, su webbook.nist.gov. URL consultato l'8 agosto 2023.
- ^ (EN) Jingbai Li e Steven A. Lopez, Multiconfigurational Calculations and Nonadiabatic Molecular Dynamics Explain Tricyclooctadiene Photochemical Chemoselectivity, in The Journal of Physical Chemistry A, vol. 124, n. 38, 24 settembre 2020, pp. 7623–7632, DOI:10.1021/acs.jpca.0c05280. URL consultato l'8 febbraio 2024.
- ^ L. Cessar, P. E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane. In: J. Am. Chem. Soc. 92, 1972, S. 3515–3518, DOI: 10.1021/ja00714a075.
- ^ (EN) Philip E. Eaton, Mao-Xi Zhang e Richard Gilardi, Octanitrocubane: A New Nitrocarbon, in Propellants, Explosives, Pyrotechnics, vol. 27, n. 1, 2002-03, pp. 1–6, DOI:10.1002/1521-4087(200203)27:1<1::AID-PREP1>3.0.CO;2-6. URL consultato l'8 agosto 2023.
- ^ (EN) Min‐Hsien Liu e Chun‐Chih Lin, Theoretical modeling of the chemical synthesis and detonation performance of polynitrocubane derivatives, in International Journal of Quantum Chemistry, vol. 120, n. 5, 2020-03, DOI:10.1002/qua.26117. URL consultato il 24 gennaio 2023.
- ^ (EN) Tristan A. Reekie, Craig M. Williams e Louis M. Rendina, Cubanes in Medicinal Chemistry, in Journal of Medicinal Chemistry, vol. 62, n. 3, 14 febbraio 2019, pp. 1078–1095, DOI:10.1021/acs.jmedchem.8b00888. URL consultato l'8 agosto 2023.
- ^ (EN) S. Shi, W. Ji e S. H. Tang, Synthesis and Optical Limiting Capability of Cubane-like Mixed Metal Clusters (n-Bu4N)3 (X = Cl and I), in Journal of the American Chemical Society, vol. 116, n. 8, 1994-04, pp. 3615–3616, DOI:10.1021/ja00087a064. URL consultato l'8 agosto 2023.
- ^ (EN) L. S. Barbosa, E. Moreira e A. R. Lopes, Cubane and cubanoid: Structural, optoelectronic and thermodynamic properties from DFT and TD-DFT method, in Journal of Molecular Graphics and Modelling, vol. 103, 1º marzo 2021, pp. 107820, DOI:10.1016/j.jmgm.2020.107820. URL consultato l'8 agosto 2023.
- ^ (EN) Liqi Wang, Xujun Zheng e Tatiana B. Kouznetsova, Mechanochemistry of Cubane, in Journal of the American Chemical Society, vol. 144, n. 50, 21 dicembre 2022, pp. 22865–22869, DOI:10.1021/jacs.2c10878. URL consultato l'8 agosto 2023.
- ^ (EN) Philip E. Eaton e Thomas W. Cole, The Cubane System, in Journal of the American Chemical Society, vol. 86, n. 5, 1964-03, pp. 962–964, DOI:10.1021/ja01059a072. URL consultato l'8 febbraio 2024.
Bibliografia
- (EN) H. Hopf, Classics in Hydrocarbon Chemistry: Syntheses, Concepts, Perspectives, Wiley, 2000, ISBN 978-3-527-29606-4.
- (EN) J. Law, A Dictionary of Science, Oxford University Press, 2017, ISBN 978-0-19-106919-2.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su cubano
Wikimedia Commons contiene immagini o altri file su cubano