Atoomstraal
Tegenwoordig is Atoomstraal een thema dat de aandacht heeft getrokken van mensen over de hele wereld. Met zijn relevantie in de huidige samenleving blijft Atoomstraal een punt van discussie op verschillende gebieden, van politiek tot populaire cultuur. De impact ervan is duidelijk zichtbaar op sociale netwerken, waar ideeën, meningen en debatten over Atoomstraal voortdurend worden gedeeld. Naarmate we verder in de tijd gaan, blijft Atoomstraal een actueel en actueel onderwerp, met een aanzienlijke impact op de manier waarop mensen de wereld om hen heen bekijken. In dit artikel zullen we verschillende perspectieven op Atoomstraal en het belang ervan in de moderne samenleving verkennen.
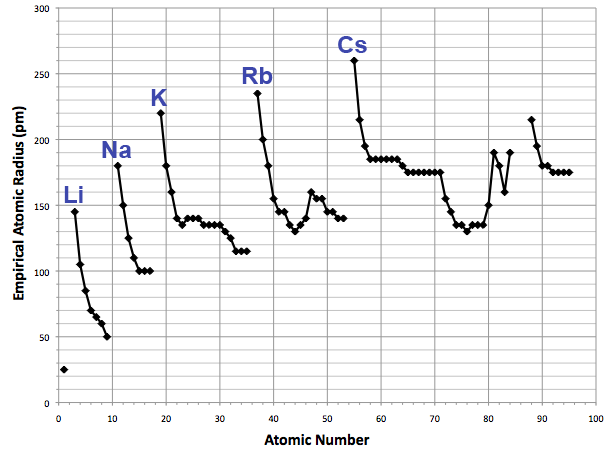
De atoomstraal of atoomradius van een chemisch element is een maat voor de omvang van de atomen, gewoonlijk een gemiddelde of typische afstand van het centrum van de kern tot een bepaalde begrenzing van de omringende elektronenwolk. Aangezien de elektronenwolk geen goed gedefinieerde fysische grens heeft, zijn er verschillende niet-equivalente definities van atoomstraal.
Afhankelijk van de definitie kan het begrip atoomstraal alleen van toepassing zijn op geïsoleerde atomen, maar ook op atomen in gecondenseerde materie, covalent gebonden in moleculen, of in geïoniseerd en aangeslagen toestanden. Drie veel gebruikte definities zijn: de vanderwaalsstraal, de ionstraal en de covalente straal.
De meeste definities van de atoomstraal van een geïsoleerd atoom geven waarden in het bereik van 30 tot 300 pm (picometer), of 0,3 tot 3 ångström. De atoomstraal is daarmee zo'n 10,000 keer groter dan de straal van zijn kern, die afmetingen heeft van ca. 1–10 fm (femtometer), en minder dan 1/1000 van de golflengte van zichtbaar licht.
Voor de dichtheid van de elektronenwolk is er een kwantumtheoretisch model, waarin de atoomstraal van een enkel atoom in vacuo berekend kan worden. Dat geeft een indruk van de afmeting van het atoom. In het periodiek systeem neemt deze afstand binnen een periode meestal naar rechts toe af, aangezien het aantal protonen in de kern toeneemt en daarmee de aantrekkingskracht op de elektronenwolk, terwijl de toename van de elektronen in dezelfde buitenste schil plaatsvindt.
Er zijn ook experimentele technieken zoals elektronendiffractie aan verdunde eenatomige gassen, waarmee in bepaalde gevallen de atoomstraal gemeten kan worden. De berekeningen en de metingen zijn in goede overeenkomst.
Chemisch is de atoomstraal niet erg relevant, omdat als er een chemische reactie plaatsvindt als twee of meer atomen elkaar benaderen, de bindingslengte tussen twee atomen in het nieuwe molecuul aanmerkelijk verschilt van de som van de atoomstralen. De bindingslengte tussen de twee in een molecuul gebonden atoomkernen is hun gemeten onderlinge afstand.