Moleculaire geometrie
In de wereld van vandaag neemt Moleculaire geometrie een centrale plaats in in de samenleving, zowel op persoonlijk, politiek, sociaal als cultureel vlak. Het belang ervan ligt in de invloed ervan op verschillende aspecten van het dagelijks leven, evenals in de rol ervan in de geschiedenis en de menselijke ontwikkeling. In de loop van de tijd is Moleculaire geometrie het onderwerp geweest van debat, studie en reflectie, wat tegenstrijdige meningen en gepassioneerde discussies heeft voortgebracht. Van de impact ervan op de economie tot de rol ervan in de individuele identiteit: Moleculaire geometrie is een onderwerp van universeel belang gebleken dat ons uitnodigt om na te denken over wie we zijn en waar we naartoe gaan. In dit artikel zullen we de verschillende facetten van Moleculaire geometrie onderzoeken, waarbij we de betekenis en impact ervan op de wereld van vandaag analyseren.
De moleculaire geometrie verwijst naar de driedimensionale schikking van de atomen in een bepaalde molecuul. De geometrie van een molecuul legt tal van belangrijke fysisch-chemische parameters vast, zoals de polariteit, dipoolmoment, aggregatietoestand, reactiviteit, kleur, magnetisme en biologische activiteit. Samen met onder andere de elektronenconfiguratie en kristallografische eigenschappen bepaalt de moleculaire geometrie de chemische structuur van samengestelde stoffen.
De moleculaire geometrie wordt meestal met behulp van een cartesisch coördinatenstelsel vastgelegd, om daarmee de positie van de atomen in de ruimte aan te duiden. Daarnaast worden ook relatieve coördinaten aangewend, waarbij de bindingslengtes en bindingshoeken tussen de atomen kunnen worden gegeven.
De moleculaire geometrie kan experimenteel worden bepaald door een aantal technieken, zoals met spectroscopie en röntgendiffractie. Voor kleinere moleculen kunnen methoden uit de theoretische en kwantumchemie, waaronder de groepentheorie, worden aangewend. Het gebruik van krachtige computers is hierbij een grote hulp.
Types moleculaire structuren
De verschillende conventionele geometrieën worden op basis van onder meer de VSEPR-theorie bepaald, die stelt dat zowel vrije als bindende elektronenparen zich in de ruimte zo ver mogelijk van elkaar moeten bevinden. Onderstaande tabel geeft een overzicht van de geometrieën met telkens een verbinding als voorbeeld:
| elektronenparen | bindingsgroepen | vrije elektronenparen | elektrongeometrie | molecuulgeometrie | bindingshoek | voorbeeld | afbeelding |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | lineair | lineair | 180 | CO2 | |
| 3 | 3 | 0 | trigonaal planair | trigonaal planair | 120 | BF3 | 
|
| 3 | 2 | 1 | trigonaal planair | gebogen | <120 | SO2 | 
|
| 4 | 4 | 0 | tetraëdisch | tetraëdisch | 109,5 | CH4 | 
|
| 4 | 3 | 1 | tetraëdisch | trigonaal piramidaal | <109,5 | NH3 | 
|
| 4 | 2 | 2 | tetraëdisch | gebogen | <109,5 | H2O | 
|
| 5 | 5 | 0 | trigonaal bipiramidaal | trigonaal bipiramidaal | ax-ax: 180
ax-eq: 90 eq-eq: 120 |
PCl5 | 
|
| 5 | 4 | 1 | trigonaal bipiramidaal | seesaw | ax-ax: 180
ax-eq: 90 eq-eq: <120 |
SF4 | 
|
| 5 | 3 | 2 | trigonaal bipiramidaal | T-vorm | 90 | ClF3 | 
|
| 5 | 2 | 3 | trigonaal bipiramidaal | lineair | 180 | XeF2 | |
| 6 | 6 | 0 | octaëdrisch | octaëdrisch | ax-ax: 180
ax-eq: 90 eq-eq: 90 |
SF6 | 
|
| 6 | 5 | 1 | octaëdrisch | vierkant piramidaal | 90 | BrF5 | 
|
| 6 | 4 | 2 | octaëdrisch | vierkant planair | 90 | XeF4 | 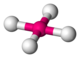
|
| 7 | 7 | 0 | pentagonaal bipiramidaal | pentagonaal bipiramidaal | ax-ax: 180
ax-eq: 90 eq-eq: 72 |
IF7 | 
|
| 7 | 6 | 1 | pentagonaal bipiramidaal | pentagonaal piramidaal | ax-eq: 90
eq-eq: 72 |
XeOF5- | 
|
| 7 | 5 | 2 | pentagonaal bipiramidaal | pentagonaal planair | 72 | XeF5- | |
| 8 | 8 | 0 | vierkant antiprismatisch | vierkant antiprismatisch | XeF82- | 
| |
| 9 | 9 | 0 | ReH92- | 
|