Fenole
W dzisiejszym artykule zagłębimy się w fascynujący świat Fenole. Od powstania do ewolucji na przestrzeni dziejów Fenole był podstawową częścią społeczeństwa, wywierając wpływ na różne obszary codziennego życia. W tym artykule zbadamy różne aspekty, które sprawiają, że Fenole jest tematem interesującym każdego, kto jest zainteresowany poszerzeniem swojej wiedzy na ten temat. Od jego wpływu na kulturę popularną po jego dzisiejsze znaczenie – zagłębimy się w szczegółową analizę, która pozwoli nam w pełni zrozumieć znaczenie i rolę, jaką odgrywa Fenole w naszym świecie. Nie przegap tego kompletnego przewodnika, który poprowadzi Cię do odkrycia wszystkiego, co musisz wiedzieć o Fenole!

Fenole – związki organiczne zawierające grupy hydroksylowe związane bezpośrednio z atomami węgla w pierścieniu aromatycznym (w przeciwieństwie do alkoholi aromatycznych, np. alkoholu benzylowego, w których grupa hydroksylowa przyłączona jest do alkilowego atomu węgla). Wykazują znacznie większą kwasowość niż alkohole i mogą tworzyć z mocnymi zasadami sole, fenolany. Najprostszym fenolem z jedną grupą hydroksylową jest fenol.
Wzór ogólny: ArOH, gdzie Ar – grupa arylowa, OH – grupa hydroksylowa
Właściwości chemiczne
Fenole wykazują odczyn lekko kwasowy w wyniku dysocjacji elektrolitycznej, w trakcie której rozpadają się na jon hydroniowy i fenolanowy. Reagują z aktywnymi metalami, zasadami i tlenkami zasadowymi z wytworzeniem soli – fenolanów, np.:
Ulegają reakcji estryfikacji podobnie jak alkohole z wytworzeniem odpowiednich estrów arylowych (np. octan fenylu).
Łatwo ulegają reakcji substytucji elektrofilowej w pozycjach orto i para (np. nitrowaniu i sulfonowaniu) dzięki silnej aktywacji pierścienia aromatycznego przez grupę hydroksylową, np.
- Ar–OH + HNO3 → O2N–Ar–OH + H2O
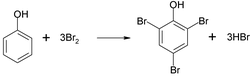
Szybko odbarwiają wodę bromową, np. :
Fenole są podatne na utlenianie. Na powietrzu tworzą barwne produkty utleniania i dimeryzacji oraz trimeryzacji.
Utlenianie (do chinonów) szczególnie łatwo zachodzi dla pochodnych dihydroksylowych:
- hydrochinon → 1,4-benzochinon (katalizatorami mogą być dichromian sodu, kwas siarkowy)
Identyfikacja
Fenole identyfikuje się za pomocą soli żelaza(III) barwy pomarańczowej. W wyniku reakcji powstaje związek kompleksowy o barwie fioletowej (ciemnogranatowej).
Metody otrzymywania fenoli
- Hydroliza chlorowcopochodnych arenów. Reakcję tę trzeba przeprowadzać w wysokich temperaturach, gdyż chlorowcopochodne arenów ulegają hydrolizie dużo trudniej niż chlorowcopochodne alkanów (podczas hydrolizy których powstają alkohole). W przemyśle stosuje się jednak inne techniki, które są charakterystyczne dla poszczególnych fenoli.
- Metoda kumenowa (z benzenu i prop-2-enu).
- Z wykorzystaniem reakcji Sandmeyera, w ciągu reakcji: ArH → ArNO2 → ArNH2 → +− → ArOH. Ostatni etap – hydrolizę soli diazoniowej – przeprowadza się w roztworze azotanu miedzi(II) w obecności Cu2O
Przykłady fenoli
Wiele fenoli i polifenoli występuje naturalnie, np.
Fenole jako środki dezynfekujące
Po raz pierwszy zastosowane w 1865 r. Do oceny skuteczności i siły działania wyznacza się tzw. współczynnik fenolowy – oznaczający, ile razy dany środek jest silniejszy/słabszy w porównaniu z czystym fenolem w odniesieniu do tego samego typu drobnoustrojów.
Mechanizm działania – polega na denaturacji białek bakteryjnych oraz inaktywacji niektórych enzymów niezbędnych w procesach życiowych.
Czas działania – do 24 godzin
Zastosowanie – jako środki konserwujące w preparatach farmaceutycznych oraz w dentystyce, gdzie nasączony związkiem jałowy wacik umieszcza się w komorze zęba. Działanie antyseptyczne uzyskuje się wówczas do głębokości 15 mm.
Przypisy
- ↑ Donald J. Cram, George S. Hammond, Chemia organiczna, Warszawa: WNT, 1963, s. 359.
- ↑ J.D. Roberts, M.C. Caserio: Chemia organiczna. Warszawa: PWN, 1969, s. 920.
- ↑ J.D. Roberts, M.C. Caserio: Chemia organiczna. Uzupełnienie. Warszawa: PWN, 1970, s. 281.
- ↑ John McMurry: Chemia organiczna. Wyd. 3. T. 4. Warszawa: PWN, 2005, s. 917–918. ISBN 83-01-14406-8.