Azotat de amoniu
În lumea de astăzi, Azotat de amoniu a fost un subiect relevant care a captat atenția societății în general. Odată cu progresul tehnologiei și globalizării, Azotat de amoniu a devenit un subiect de discuție și dezbatere în diverse domenii, de la politică la știință, inclusiv cultură și divertisment. Pe măsură ce Azotat de amoniu continuă să ne influențeze viețile în moduri neașteptate, este esențial să analizăm implicațiile și consecințele sale în societatea contemporană. În acest articol, vom arunca o privire mai atentă asupra fenomenului Azotat de amoniu și asupra influenței sale asupra diferitelor aspecte ale vieții noastre de zi cu zi.
| Azotat de amoniu | |
 | |
 | |
| Alte denumiri | Nitrat de amoniu, salpetru de amoniu |
|---|---|
| Identificare | |
| Număr CAS | 6484-52-2 |
| ChEMBL | CHEMBL1500032 |
| PubChem CID | 22985 |
| Informații generale | |
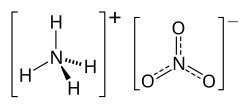
| Formulă chimică | NH4NO3 |
| Aspect | pulbere albă |
| Masă molară | 80,04 g/mol |
| Proprietăți | |
| Densitate | 1,725 g/cm3 (20 °C) |
| Starea de agregare | solidă |
| Punct de topire | 169,6 °C |
| Punct de fierbere | 210 °C |
| Solubilitate | bună în apă (1177 g/l la 20 °C) |
| Anion | Azotat |
| Cation | Amoniu |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Azotatul de amoniu (denumit și nitrat de amoniu sau „salpetru de amoniu”) este un compus anorganic, sarea ce ia naștere din amoniac și acid azotic, cu formula chimică NH
4NO
3. Este un compus solid cristalin, foarte solubil în apă și higroscopic, dar care nu formează forme hidratate. Este utilizat majoritar în agricultură, fiind un îngrășământ ce aduce un aport bogat de azot.[2]
Obținere
Cea mai simplă metodă de obținere a nitratului de amoniu este reacția de neutralizare a acidului azotic sau nitric cu amoniac:[3]
Proprietăți
Proprietăți chimice
Azotatul de amoniu este o sare ce conține anionul nitrat NO3− și cationul amoniu NH4+. Se descompune la încălzire (la temperaturi mai mici de 300 °C) în apă și oxid de azot (gaz ilariant):
La temperaturi mai mari de 300 °C, predomină următorul proces de descompunere:[4]

Ambele reacții de descompunere sunt procese puternic exoterme ce duc la obținerea unor gaze. În unele condiții, aceste procese pot să devină explozive, ceea ce poate duce la accidente de proporții mari, de exemplu explozia de la Mihăilești. Exploziile care sunt cauzate de nitratul de amoniu sunt acompaniate de un nor de culoare roșu-oranj, acesta fiind datorat cantității mari de dioxid de azot care este obținut ca produs secundar al descompunerii.[5]
Ambii atomi de azot au atins pragul de oxidare (0), o astfel de reacție când un element este oxidat de același element, explică puterea exploziei prin transformarea rapidă a nitratului de amoniu din starea de agregare solidă direct în cea gazoasă (azot, oxigen, și vapori de apă). Recuperarea acidului azotic se realizează prin reacția cu acidul sulfuric concentrat și distilare:
Nitratul de amoniu întreține arderea, iar la supraîncălzire poate exploda, din această cauză este folosit ca îngrășământ numai sub formă de amestec cu alte substanțe.
Faze cristaline
Faza Temperatura (°C) Simetrie (lichid) (peste 169,6) I 169,6 -> 125,2 cubic II 125,2 -> 84,2 tetragonal III 84,2 -> 32,3 α-rombic IV 32,3 -> −16,8 β-rombic V sub −16,8 tetragonal[6]
Utilizare
Nitratul de amoniu face parte din îngrășămintele naturale azotate,[7] și conține 34% azot în procente de masă (mai puțin în comparație cu ureea).[8]
Este și parte componentă a unor explozivi ca ANFO (sau ANDEX, care este un amestec de nitrat de amoniu și un ulei mineral ca dieselul de exemplu; acesta este utilizat ca exploziv industrial)[9]:1 și se poate asocia cu nitrat de glicerină, nitroglicol, dinitrotoluen, trinitrotoluen, pentrit, hexogen etc. În amestec cu TNT poartă numele de Amatol, iar în amestec cu aluminiu, TNT și alți explozivi se numește Torpex.
Note
- ^ „Azotat de amoniu”, 6484-52-2 (în engleză), PubChem, accesat în
- ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ^ „Archived copy” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Greenwood, Norman N.; Earnshaw, Alan (). Chemistry of the Elements (ed. 2nd). Oxford: Butterworth-Heinemann. p. 469. ISBN 0080379419.
- ^ „The chemistry behind the Beirut explosion”.
- ^ Choi, C. S.; Prask, H. J. (). „The structure of ND4NO3 phase V by neutron powder diffraction”. Acta Crystallographica B. 39 (4): 414–420. doi:10.1107/S0108768183002669
 .
.
- ^ „Ammonium Nitrate Fertilizer: How To Use Ammonium Nitrate In Gardens”, Gardening Know How, accesat în
- ^ „Nutrient Content of Fertilizer Materials” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ Cook, Melvin A. (). The Science of Industrial Explosives. IRECO Chemicals. p. 1. ASIN B0000EGDJT.




