Triossido di diazoto
Nel mondo di oggi, Triossido di diazoto è un argomento che suscita grande interesse e dibattito nella società. Con il progresso della tecnologia e della globalizzazione, Triossido di diazoto è diventata una questione rilevante che colpisce persone di tutte le età e nazionalità. Che sia professionale, personale o accademico, Triossido di diazoto ha un impatto significativo sulla vita quotidiana di molte persone. In questo articolo esploreremo diversi aspetti legati a Triossido di diazoto e analizzeremo la sua influenza in vari ambiti, nonché le possibili implicazioni per il futuro.
| Triossido di diazoto | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| trioxido-1κ2O,2κO-dinitrogen(N—N) | |
| Nomi alternativi | |
| anidride nitrosa, ossido di azoto(III) sesquiossido di azoto (arcaico) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O3 |
| Aspetto | solido o liquido blu |
| Numero CAS | |
| Numero EINECS | 234-128-5 |
| PubChem | 61526 |
| SMILES | N(=O)(=O) |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,447 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | -100,7 °C (172,5 K) |
| Temperatura di ebollizione | ~ 3,5 °C (~ 276,6 K) (con dissociazione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
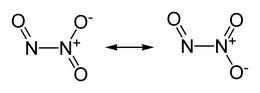
Il triossido di diazoto, nome sistematico ossido di azoto(III) e noto come anidride nitrosa in nomenclatura tradizionale, è un ossido dell'azoto di formula molecolare N2O3 in cui N è allo stato di ossidazione +3 (medio). La sua formula semistrutturale è ON−N(O)2, dove un atomo di azoto è +2 e l'altro +4. Nonostante questa insolita struttura, formalmente è l'anidride dell'acido nitroso, ma si mostra esserlo anche di fatto (vide infra). Questa forma molecolare vale nella condizione più stabile per questo composto, che si ha a basse temperature, sia allo stato solido che in parte allo stato liquido (punto di fusione -100,7 °C, punto di ebollizione ~ 3,5 °C), entrambi di colore azzurro.
Già in parte allo stato liquido, infatti, ma specialmente allo stato di vapore si instaura un equilibrio di dissociazione in monossido di azoto e biossido di azoto e il grado di dissociazione aumenta all'aumentare della temperatura:
La dissociazione e quindi la formazione dei prodotti inizia ad essere apprezzabile a partire da circa -30 °C.
Proprietà
Il triossido di diazoto è già scarsamente stabile di suo, essendo un composto piuttosto endotermico, ΔHƒ° = +84,82 kJ/mol e l'altro suo possibile isomero molecolare (O=N−O−N=O, nitrito di nitrosile, la forma attesa per l'anidride nitrosa) è ancora meno stabile (ΔHƒ°calcolato = +97,9 kJ/mol) e di esso si conosce solo qualche dato spettrale. Un terzo possibile isomero sarebbe quello ionico, nitrito di nitrosonio che è sconosciuto materialmente, ma calcoli teorici prevedono per esso un'entalpia di formazione standard parecchio più alta, almeno 113,8 kJ/mol.
Il triossido di diazoto è solubile in tetracloruro di carbonio, cloroformio, benzene e toluene, dando in ogni caso soluzioni azzurre.
Da indagini spettroscopiche rotazionali nella regione delle microonde su N2O3 si ricava che la molecola è planare con simmetria Cs ed alquanto polare (μ = 2,12 D), con il nitrosile NO parzialmente positivo e il gruppo nitro NO2 parzialmente negativo.
Da indagini spettroscopiche infrarosse, effettuate in alta risoluzione con trasformata di Fourier sul vapore di N2O3 a 230 K (-43 °C), risulta, tra l'altro, che il legame N−N è insolitamente lungo, ben 186,4 pm, e quindi presumibilmente molto debole; per confronto, il valor medio di tale legame ammonta a 147 pm. e nell'idrazina (H2N−NH2) è ancora un po' più corto (145 pm). In questo contesto è bene comunque notare che anche il legame N−N nel tetrossido di diazoto (O2N−NO2), che è soggetto a dissociazione, è anch'esso molto lungo: 178,2 pm.
Sintesi e reattività
La maniera più semplice di ottenere il triossido di diazoto consiste nel far condensare a bassa temperatura (< -20 °C) il monossido di azoto e il biossido di azoto:
NO + NO2 ⇄ N2O3
oppure ancora il monossido di azoto e l'ossigeno in quantità stechiometrica. Si ottiene in tal modo un liquido azzurro intenso che quando viene gradatamente riscaldato diviene di colore verdastro, perché in tal modo cresce la quantità formata di NO2, che è arancione.
Un'altra via consiste nel far reagire a bassa temperatura il tetrossido di diazoto liquido con carbonato di litio, in presenza di tracce di umidità:
Li2CO3 (s) + N2O4 (liq) → 2 LiNO3 + N2O3 + CO2
La reattività di N2O3 in condizioni ordinarie è spesso approssimabile a quella di una miscela equimolecolare di monossido di azoto NO e diossido di azoto NO2. Nonostante che la struttura della molecola non sia quella normale per un'anidride inorganica e nonostante la dissociazione, la reazione di N2O3 con soluzioni acquose fornisce soluzioni di acido nitroso:
N2O3 + H2O → 2 HNO2
Questo, essendo un acido debole, nella soluzione è parzialmente dissociato in ione idrossonio e ione nitrito:
Questa trasformazione del triossido di diazoto in acqua è molto più rapida e completa se la soluzione è alcalina e in tal caso si ottengono i corrispondenti nitriti.
Il triossido di diazoto reagisce con acidi molto forti, come l'acido perclorico o tetrafluoroborico, per generare i corrispondenti sali di nitrosonio:
N2O3 + 3 HClO4 → 2 + − + + −
N2O3 + 2 HBF4 → 2 + − + H2O
Note
- ^ dinitrogen trioxide (CHEBI:29799), su ebi.ac.uk. URL consultato il 16 febbraio 2024.
- ^ a b (EN) Dario A. Vitturi, Lucia Minarrieta e Sonia R. Salvatore, Convergence of biological nitration and nitrosation via symmetrical nitrous anhydride, in Nature Chemical Biology, vol. 11, n. 7, 2015-07, pp. 504–510, DOI:10.1038/nchembio.1814. URL consultato il 16 febbraio 2024.
- ^ Al quale numero di ossidazione fa riferimento il nome sistematico.
- ^ (DE) Ralf Steudel, Chemie der Nichtmetalle, 4ª ed., Walter de Gruyter GmbH, 2014, p. 366, DOI:10.1515/9783110307979.
- ^ Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 444, ISBN 978-0-7506-3365-9.
- ^ a b Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 454, ISBN 978-0-7506-3365-9.
- ^ Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3., vollständig überarbeitete Auflage, Springer Spektrum, 2016, p. 566, DOI:10.1007/978-3-662-45067-3, ISBN 978-3-662-45066-6. URL consultato il 15 febbraio 2024.
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 15 febbraio 2024.
- ^ a b (EN) I. I. Zakharov e O. I. Zakharova, Nitrosonium nitrite isomer of N2O3: Quantum-chemical data, in Journal of Structural Chemistry, vol. 50, n. 2, 1º aprile 2009, pp. 212–218, DOI:10.1007/s10947-009-0031-1. URL consultato il 15 febbraio 2024.
- ^ Experimental data for ONONO (Nitrosyl nitrite), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ P. W. Schenk, Handbook of Preparative Inorganic Chemistry, a cura di Georg Brauer, vol. 1, 1963, p. 488, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
- ^ Experimental data for N2O3 (Dinitrogen trioxide), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ (EN) K.-H. Hellwege, A. M. Hellwege (a cura di), Molecular Constants from Microwave, Molecular Beam, and Electron Spin Resonance Spectroscopy, in Landolt-Börnstein - Group II Molecules and Radicals, 1974, DOI:10.1007/b19951. URL consultato il 15 febbraio 2024.
- ^ a b F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 328, ISBN 0-471-19957-5.
- ^ (EN) Leslie A. Chewter, Ian W.M. Smith e Gregory Yarwood, A high resolution FTIR spectroscopic study of the nv 1 ( n = 1–4) bands of N 2 O 3, in Molecular Physics, vol. 63, n. 5, 10 aprile 1988, pp. 843–864, DOI:10.1080/00268978800100601. URL consultato il 15 febbraio 2024.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ Experimental data for N2H4 (Hydrazine), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ Bruce W. McClelland, Grete Gundersen e Kenneth Hedberg, Reinvestigation of the Structure of Dinitrogen Tetroxide, N2O4, by Gaseous Electron Diffraction, in The Journal of Chemical Physics, vol. 56, n. 9, 1º maggio 1972, pp. 4541–4545, DOI:10.1063/1.1677901. URL consultato il 15 febbraio 2024.
- ^ a b Therald Moeller, Chemistry with Inorganic Qualitative Analysis, ACADEMIC PRESS, INC., 1980, p. 666, ISBN 978-0-12-503350-3, LCCN 79-89282.
- ^ Rajni Garg e Randhir Singh, 6. Non-aqueous Solvents, in Inorganic Chemistry, McGraw Hill Education, 2015.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 825, ISBN 978-3-11-026932-1.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, pp. 810-811, ISBN 978-3-11-026932-1.
- ^ James E. House e James Evan House, Inorganic chemistry, Elsevier Academic Press, 2008, p. 491, ISBN 978-0-12-356786-4.
- ^ P. W. Schenk, Handbook of Preparative Inorganic Chemistry, a cura di Georg Brauer, vol. 1, 1963, p. 224, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Collegamenti esterni
- (EN) dinitrogen trioxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
